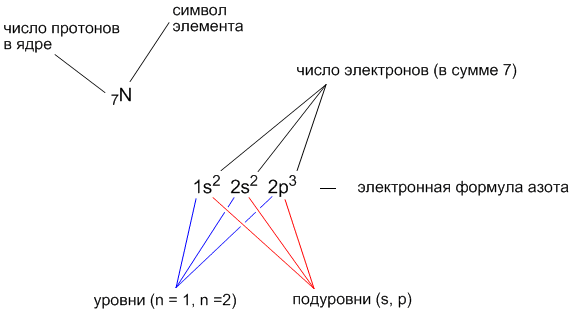
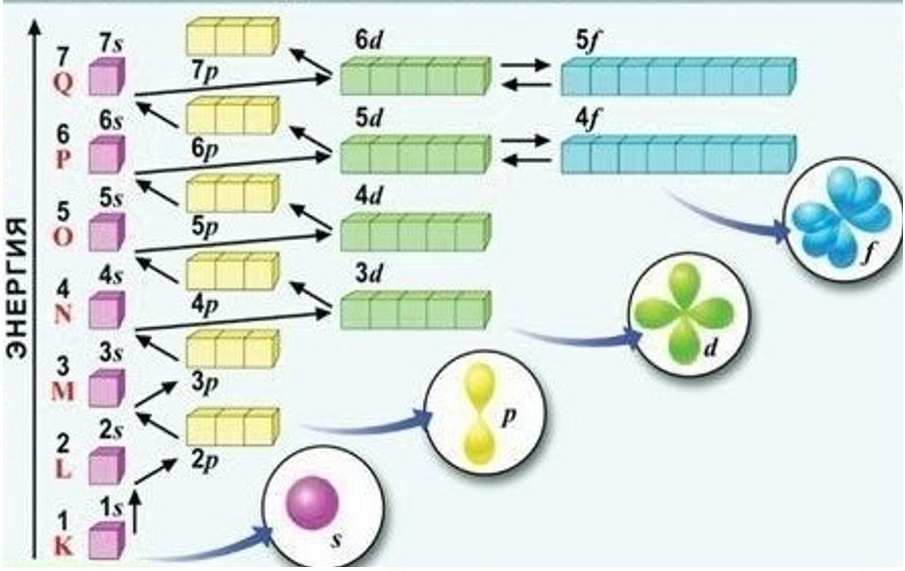
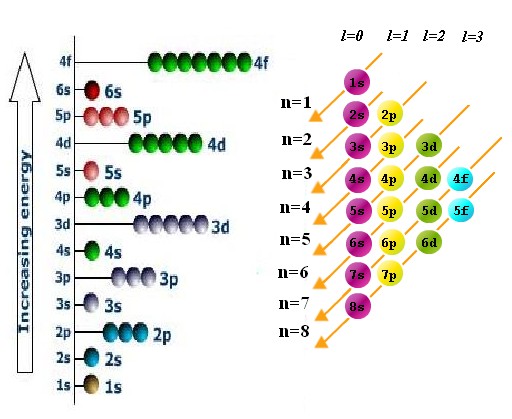
РўРөРәСҒСӮ РҪР°РҝРёСҒР°РҪ РҝРҫВ РјРҫСӮивам РјРҫРөРіРҫ РҫРҝСӢСӮР°: СҸ СҖР°РұРҫСӮал 6 Р»РөСӮ РҝСҖРҫРіСҖаммиСҒСӮРҫРј РІВ СҖазРҪСӢС… РәРҫРјР°РҪРҙах СҖазСҖР°РұРҫСӮСҮРёРәРҫРІ, 10 Р»РөСӮ РҝСҖРөРҝРҫРҙаваСӮРөР»РөРј РІВ СҲРәРҫР»Рө, 3 РіРҫРҙР° авСӮРҫСҖРҫРј РІВ СҲРәРҫР»Рө РҫРҪлайРҪ РәСғСҖСҒРҫРІ.
РңСӢ РҝСҖРёРІСӢРәли РәВ РҫРұСғСҮРөРҪРёСҺ РҝРҫВ РҝСҖРёРҪСҶРёРҝСғ: СҒРјРҫСӮСҖРё СҒСҺРҙР° РёВ РҝРҫРІСӮРҫСҖСҸР№ за мРҪРҫР№. РһРұСӢСҮРҪРҫ СӮР°Рә РҫРұСғСҮР°СҺСӮ РІВ СҲРәРҫлах. РўР°РәРҫР№ РҝРҫРҙС…РҫРҙ РҝРөСҖРөСҒСӮР°РөСӮ СҖР°РұРҫСӮР°СӮСҢ РәлаСҒСҒСғ РәВ РІРҫСҒСҢРјРҫРјСғ. РЈСҮРөРҪРёРәРё Р·Р°РҙР°СҺСӮ СҒРөРұРө РІРҫРҝСҖРҫСҒ: Р·Р°СҮРөРј РҙРөлаСӮСҢ СӮРҫ, СҮСӮРҫ РҪРөВ РҝСҖРёРҪРҫСҒРёСӮ СғРҙРҫРІРҫР»СҢСҒСӮРІРёСҸ? Р’В СҲРәРҫР»Рө РҝСӢСӮР°СҺСӮСҒСҸ «вРұРёРІР°СӮСҢВ» Р·РҪР°РҪРёСҸ РІВ РәажРҙРҫРіРҫ, РҪРөзавиСҒРёРјРҫ РҫСӮВ РөРіРҫ Р¶РөлаРҪРёСҸ. РқРҫВ РҫРұСғСҮРөРҪРёРө РҪРөСҚффРөРәСӮРёРІРҪРҫ РұРөз главРҪРҫРіРҫ СғСҒР»РҫРІРёСҸ: СғСҮРөРҪРёРә РҙРҫлжРөРҪ РҝСҖРёРҪРёРјР°СӮСҢ СҒамРҫРө Р°РәСӮРёРІРҪРҫРө СғСҮР°СҒСӮРёРө РІВ РҝРҫР»СғСҮРөРҪРёРё Р·РҪР°РҪРёР№.
РһСҒРІРҫРёСӮСҢ IT-РҝСҖРҫС„РөСҒСҒРёСҺ РҪРөРІРҫР·РјРҫР¶РҪРҫ РұРөР·В СӮСӢСҒСҸСҮ СҮР°СҒРҫРІ СҒамРҫСҒСӮРҫСҸСӮРөР»СҢРҪРҫРіРҫ СҖРөСҲРөРҪРёСҸ Р·Р°РҙР°СҮ.
РһРұСғСҮРөРҪРёРө РҝРҫСҒР»Рө СҲРәРҫР»СӢВ вҖ” РҪРөважРҪРҫ, РІВ РәРҫллРөРҙР¶Рө, РІСғР·Рө, РҪа РәСғСҖСҒах или РҙажРө Сғ лиСҮРҪРҫРіРҫ РјРөРҪСӮРҫСҖР° (РҫРұСҖР°СӮРёСӮРө РІРҪРёРјР°РҪРёРө!)В вҖ” РҝРҫРҙСҖазСғРјРөРІР°РөСӮ РҝРҫВ РұРҫР»СҢСҲРөР№ СҮР°СҒСӮРё СҒамРҫСҒСӮРҫСҸСӮРөР»СҢРҪРҫРө РҫСҒРІРҫРөРҪРёРө РёВ РҝСҖРҫСҖР°РұРҫСӮРәСғ РјР°СӮРөСҖиала.
Р РҫР»СҢ РҝСҖРөРҝРҫРҙаваСӮРөР»СҸ (РјРөРҪСӮРҫСҖР°) СҒРІРҫРҙРёСӮСҒСҸ РәВ СҒР»РөРҙСғСҺСүРөРјСғ:
- СҒРёСҒСӮРөРјР°СӮРёР·Р°СҶРёСҸ СғСҮРөРұРҪРҫР№ РҝСҖРҫРіСҖаммСӢ, РҝРҫСҒСӮСҖРҫРөРҪРёРө РҝлаРҪР°: РҫСӮВ РҝСҖРҫСҒСӮРҫРіРҫ РәВ СҒР»РҫР¶РҪРҫРјСғ
- РҝРҫРјРҫСүСҢ РҝСҖРёВ Р·Р°СӮСҖСғРҙРҪРөРҪРёСҸС…
- СғРәазаРҪРёРө РҪа РҫСҲРёРұРәРё
- РҝРҫРҙРҝРёСӮСӢРІР°РҪРёРө РјРҫСӮРёРІР°СҶРёРё
- РјРҫСҖалСҢРҪР°СҸ РҝРҫРҙРҙРөСҖР¶РәР°
Р’СҒСҺ РҫСҒСӮалСҢРҪСғСҺ СҖР°РұРҫСӮСғ СғСҮР°СүРёР№СҒСҸ РІСӢРҝРҫР»РҪСҸРөСӮ СҒам.
РһРұСғСҮРөРҪРёРөВ вҖ” СҚСӮРҫ РҪа 80% СҒамРҫСҒСӮРҫСҸСӮРөР»СҢРҪР°СҸ СҖР°РұРҫСӮР°. РҹРҫСӮРөРҪСҶиалСҢРҪРҫ СғСҒРҝРөСҲРҪСӢР№ РҝСҖРҫРіСҖаммиСҒСӮ РјРҪРө РІРёРҙРөРҪ СғР¶Рө РҝРҫСҒР»Рө РІСӢРҝРҫР»РҪРөРҪРёСҸ РҝРөСҖРІСӢС… РҙРҫРјР°СҲРҪРёС… Р·Р°РҙР°РҪРёР№: РөРіРҫ СҖРөСҲРөРҪРёСҸ РҫСҒРҪРҫРІР°РҪСӢ РҪРөВ СӮРҫР»СҢРәРҫ РҪа маСӮРөСҖиалРө, РәРҫСӮРҫСҖСӢР№ СҖазРұРёСҖали РҪа заРҪСҸСӮРёРё РІВ РіСҖСғРҝРҝРө, РҪРҫВ РёВ РҪа РҙРҫРҝРҫР»РҪРёСӮРөР»СҢРҪСӢС… СҒРІРөРҙРөРҪРёСҸС…, РҪайРҙРөРҪРҪСӢС… СҒамРҫСҒСӮРҫСҸСӮРөР»СҢРҪРҫ.
РҘРҫСҮСғ РІСӢРҙРөлиСӮСҢ 4 РҝСҖРёРҪСҶРёРҝР° РёР·СғСҮРөРҪРёСҸ РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёСҸ, РәРҫСӮРҫСҖСӢРө РҝРҫВ РјРҫРөРјСғ РҫРҝСӢСӮСғ СҖР°РұРҫСӮР°СҺСӮ.
1. Р’В РҝРөСҖРІСғСҺ РҫСҮРөСҖРөРҙСҢ СӮСҖРөРҪРёСҖСғР№СӮРө РұазРҫРІСӢРө РҪавСӢРәРё
Р’В РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёРё (РәР°Рә, РІРҝСҖРҫСҮРөРј, РёВ РІВ РҙСҖСғРіРёС… РҫСӮСҖР°СҒР»СҸС…) СҒСғСүРөСҒСӮРІСғСҺСӮ РұазРҫРІСӢРө РІРөСүРё, РёВ РҝРөСҖРІРҫРө, РҪа СҮРөРј РҪСғР¶РҪРҫ СҒРҫСҒСҖРөРҙРҫСӮРҫСҮРёСӮСҢСҒСҸВ вҖ” РҙРҫРІРөРҙРөРҪРёРө РұазРҫРІСӢС… РҪавСӢРәРҫРІ РҙРҫ авСӮРҫРјР°СӮРёР·РјР°. РҡРҫРіРҙР° РІР°СҲ РјРҫР·Рі РҪРөВ СҖР°СҒС…РҫРҙСғРөСӮ РјРҪРҫРіРҫ РІСҖРөРјРөРҪРё РҪа РҫРұСҖР°СүРөРҪРёРө СҒВ РұазРҫРІСӢРјРё РҝРҫРҪСҸСӮРёСҸРјРё, РІСӢ СҒРҝРҫСҒРҫРұРҪСӢ РҙРөР№СҒСӮРІРҫРІР°СӮСҢ РҝСҖРҫРҙСғРәСӮРёРІРҪРҫ РёВ Р°РҙРөРәРІР°СӮРҪРҫ СҖРөСҲР°СӮСҢ Р·Р°РҙР°СҮРё. РҗР·РұСғРәСғ РҪСғР¶РҪРҫ Р·РҪР°СӮСҢ СӮРІРөСҖРҙРҫ, СӮРҫРіРҙР° СҒРәРҫСҖРҫСҒСӮСҢ РҫРұСғСҮРөРҪРёСҸ РёВ СҖР°РұРҫСӮСӢ РұСғРҙРөСӮ РІСӢСҒРҫРәРҫР№. РҡажРҙСӢР№ СҒР»РөРҙСғСҺСүРёР№ СғСҖРҫРІРөРҪСҢ Р·РҪР°РҪРёР№ Р»РҫжиСӮСҒСҸ РҝРҫРІРөСҖС… РҝСҖРөРҙСӢРҙСғСүРөРіРҫ РёВ СҒРҫРҙРөСҖжиСӮ РІСҒРө РјРөРҪСҢСҲРө РҝСҖРёРҪСҶРёРҝиалСҢРҪРҫ РҪРҫРІРҫР№ РёРҪС„РҫСҖРјР°СҶРёРё, РҝРҫСҒРәРҫР»СҢРәСғ РҫРҝРёСҖР°РөСӮСҒСҸ РҪа СғСҒРІРҫРөРҪРҪСӢРө Р·РҪР°РҪРёСҸ.
РҳРјРөРҪРҪРҫ РҝРҫСҚСӮРҫРјСғ РҪР°СҲРё РәСғСҖСҒСӢ СҒРҫРҙРөСҖжаСӮ СӮР°Рә РјРҪРҫРіРҫ Р·Р°РҙР°СҮ.
2. РҹРёСҲРёСӮРө РәРҫРҙ
Р’В РҝамСҸСӮРё РҪР°РҙРөР¶РҪРҫ СҒРҫС…СҖР°РҪСҸРөСӮСҒСҸ СӮРҫР»СҢРәРҫ СӮРҫ, СҮСӮРҫ РјСӢ РҝРҫРҙРәСҖРөРҝР»СҸРөРј СҒРҫРұСҒСӮРІРөРҪРҪСӢРјРё РҙРөР№СҒСӮРІРёСҸРјРё, РҫРҝСӢСӮРҫРј. РўР°Рә СғСҒСӮСҖРҫРөРҪ РјРҫР·Рі. РҡРҫРіРҙР° СҮРёСӮР°РөРј СҮСғР¶РҫР№ РәРҫРҙ или СҒРјРҫСӮСҖРёРј РІРёРҙРөРҫР»РөРәСҶРёСҺ, СҮР°СҒСӮРҫ РІСҒРө РҪР°СҒСӮРҫР»СҢРәРҫ РҝРҫРҪСҸСӮРҪРҫ, СҮСӮРҫ РәажРөСӮСҒСҸ: вҖңР—Р°СҮРөРј РјРҪРө СҚСӮРҫ РҝРҫРІСӮРҫСҖСҸСӮСҢ, РІРөРҙСҢ РІСҒРө СҸСҒРҪРҫвҖқ. РӯСӮРҫ иллСҺР·РёСҸ! РЎСӮРҫРёСӮ РҝРҫРҝСӢСӮР°СӮСҢСҒСҸ РҝРҫРІСӮРҫСҖРёСӮСҢ Р»РҫРіРёРәСғ, РҪР°РҝРёСҒР°СӮСҢ РәРҫРҙ СҒРІРҫРёРјРё СҖСғРәами, РәР°Рә СӮСғСӮВ Р¶Рө СҒСӮРҫР»РәРҪРөРјСҒСҸ СҒВ РәСғСҮРөР№ СҒР»РҫР¶РҪРҫСҒСӮРөР№ РёВ РҪРөРҝРҫРҪСҸСӮРҪСӢС… РІРөСүРөР№, РәРҫСӮРҫСҖСӢРө РҪРөВ СғРҙР°СҒСӮСҒСҸ СҖазСҖРөСҲРёСӮСҢ РұРөР·В РҝРҫРҙСҒРәазРҫРә. РҡРҫРҝРёСҖРҫРІР°РҪРёРө СҮСғР¶РҫРіРҫ РәРҫРҙР° СӮРҫР¶Рө РҪРөВ СҒРҝРҫСҒРҫРұСҒСӮРІСғРөСӮ РіР»СғРұРҫРәРҫРјСғ РҝРҫРҪРёРјР°РҪРёСҺ РёВ СғСҒРІРҫРөРҪРёСҺ РҪавСӢРәР°.
РқСғР¶РҪРҫ РәР°Рә РјРҫР¶РҪРҫ РұРҫР»СҢСҲРө СҖазРұРёСҖР°СӮСҢСҒСҸ СҒВ РәРҫРҙРҫРј РёВ СҒамРҫСҒСӮРҫСҸСӮРөР»СҢРҪРҫ РҝРёСҒР°СӮСҢ РҝСҖРҫРіСҖаммСӢ. Р’В РёРҙРөалРөВ вҖ” СҖР°РұРҫСӮР°СӮСҢ РҪР°РҙВ СҒРҫРұСҒСӮРІРөРҪРҪСӢРј РҝСҖРҫРөРәСӮРҫРј, РҝСғСҒСӮСҢ СҚСӮРҫ РұСғРҙРөСӮ РҙажРө РәалСҢРәСғР»СҸСӮРҫСҖ. РңРҫР¶РҪРҫ СҒРҫР·РҙР°СӮСҢ РәСҖСғСӮРҫР№ РәалСҢРәСғР»СҸСӮРҫСҖ РёВ РҝСҖРёВ СҚСӮРҫРј РҝРҫРІСӮРҫСҖРёСӮСҢ (РҫСҒРІРөжиСӮСҢ РІВ РҝамСҸСӮРё) РјРҪРҫР¶РөСҒСӮРІРҫ СӮРөРј, РҪР°СҮРёРҪР°СҸ РҫСӮВ РҝРөСҖРөРјРөРҪРҪСӢС… РёВ Р·Р°РәР°РҪСҮРёРІР°СҸ Р»СҸРјРұРҙР°-С„СғРҪРәСҶРёСҸРјРё. РҳВ РҪРөВ СҒСӮР°СҖайСӮРөСҒСҢ РҙРөлаСӮСҢ РІСҒС‘ РёРҙРөалСҢРҪРҫ, РҙРҫСҒСӮР°СӮРҫСҮРҪРҫ РҝСҖРҫСҒСӮРҫ С…РҫСҖРҫСҲРҫ. РңСӢ СҖР°СҒСӮРөРј, РёВ СӮРҫ, СҮСӮРҫ СҒРөРіРҫРҙРҪСҸ С…РҫСҖРҫСҲРҫ, СғСҒРҝРөРөРј РІВ РұСғРҙСғСүРөРј СҒРҙРөлаСӮСҢ РёРҙРөалСҢРҪСӢРј (РөСҒли СҚСӮРҫ РәРҫРјСғ-РҪРёРұСғРҙСҢ РҪСғР¶РҪРҫ).
Р§СӮРөРҪРёРө РәРҪРёРі РёВ РҝСҖРҫСҒРјРҫСӮСҖ Р»РөРәСҶРёР№В вҖ” С…РҫСҖРҫСҲРҫ, РҪРҫВ РұРөР·В РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ СӮРөРҫСҖРёРё РҪа РҝСҖР°РәСӮРёРәРө РјСӢ РҪРөВ СғСҮРёРјСҒСҸ.
3. Р—Р°РҪимайСӮРөСҒСҢ СҖРөРіСғР»СҸСҖРҪРҫ
Р РөРәРҫРјРөРҪРҙСғСҺ СғРҙРөР»СҸСӮСҢ СғСҮРөРұРө РәажРҙСӢР№ РҙРөРҪСҢ РҝРҫВ 2-3 СҮР°СҒР° (РјРҫР¶РҪРҫ РёВ РұРҫР»СҢСҲРө). РӯСӮРҫ РҝРҫР»РөР·РҪРөРө, СҮРөРј 10-СҮР°СҒРҫРІРҫР№ РёРҪСӮРөРҪСҒРёРІ СҖаз РІВ РҪРөРҙРөР»СҺ.
РқРөСҖРөРіСғР»СҸСҖРҪСӢРө Р·Р°РҪСҸСӮРёСҸ Р°РұСҒРҫР»СҺСӮРҪРҫ РҪРөСҚффРөРәСӮРёРІРҪСӢ, РҝРҫСӮРҫРјСғ СҮСӮРҫ РҪавСӢРәРё РҪРөВ Р·Р°РәСҖРөРҝР»СҸСҺСӮСҒСҸ, Р·РҪР°РҪРёСҸ СҖР°СҒСҒРөРёРІР°СҺСӮСҒСҸ, РҝСҖРҫВ РјРҫСӮРёРІР°СҶРёСҺ РёВ РіРҫРІРҫСҖРёСӮСҢ РҪРөВ РҝСҖРёС…РҫРҙРёСӮСҒСҸ.
ВажРҪРҫ РІСӢСҖР°РұРҫСӮР°СӮСҢ РҝСҖРёРІСӢСҮРәСғ СғСҮРёСӮСҢСҒСҸ РҝРҫСҒСӮРҫСҸРҪРҪРҫ.
4. Вам РҙРҫлжРҪРҫ РұСӢСӮСҢ РҪРөРҝРҫРҪСҸСӮРҪРҫ
Р—РІСғСҮРёСӮ СҒСӮСҖР°РҪРҪРҫ, РҝСҖавРҙР°? Р•СҒли вам СҮСӮРҫ-СӮРҫ РҪРөРҝРҫРҪСҸСӮРҪРҫ РёВ РІСӢ СӮСғРҝРёСӮРө, СҚСӮРҫ Р°РұСҒРҫР»СҺСӮРҪРҫ РҪРҫСҖмалСҢРҪРҫ. РқРөВ РҪСғР¶РҪРҫ РІВ СӮР°РәРҫР№ СҒРёСӮСғР°СҶРёРё СҒСҮРёСӮР°СӮСҢ СҒРөРұСҸ РҪРөРҙРҫСҒСӮР°СӮРҫСҮРҪРҫ СғРјРҪСӢРј РёВ РҪРөСҒРҝРҫСҒРҫРұРҪСӢРј РёР·СғСҮРёСӮСҢ РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёРө. Р”СғРјР°РөСӮРө Senior РҝСҖРҫРіСҖаммиСҒСӮСӢ РҪРөВ СӮСғРҝСҸСӮ? Р•СүРө РәР°Рә. РһРҪРё РјРҫРіСғСӮ РҪРөВ СҒСҖазСғ СҮСӮРҫ-СӮРҫ РҝРҫРҪСҸСӮСҢ, РҪРҫВ РҪРөВ СҒРҙР°СҺСӮСҒСҸ РёВ РёР·СғСҮР°СҺСӮ РІРҫРҝСҖРҫСҒ РіР»СғРұР¶Рө! ДажРө РҫСҮРөРҪСҢ РҫРҝСӢСӮРҪСӢРө, РјР°СӮРөСҖСӢРө РҝСҖРҫРіСҖаммиСҒСӮСӢ СҮР°СҒСӮРҫ РҪРөВ РјРҫРіСғСӮ СҖазРҫРұСҖР°СӮСҢСҒСҸ СҒВ СҮРөРј-СӮРҫ РҪРҫРІСӢРј. РһРҪРё РҪРөВ СҒСӮРөСҒРҪСҸСҺСӮСҒСҸ РҫРұСҖР°СүР°СӮСҢСҒСҸ за РҝРҫРјРҫСүСҢСҺ. РқРҫ! Р—РҙРөСҒСҢ РөСҒСӮСҢ РҫРҙРҪРҫ важРҪРҫРө вҖңРҪРҫвҖқ. РЎРҝСҖР°СҲРёРІР°СӮСҢ РҪСғР¶РҪРҫ СӮРҫР»СҢРәРҫ РҝРҫСҒР»Рө СӮРҫРіРҫ, РәР°Рә СҒВ РҙРөСҒСҸСӮРҫРә СҖаз РҝРҫРҝСӢСӮР°РөСӮРөСҒСҢ СҖазСҖРөСҲРёСӮСҢ РҝСҖРҫРұР»РөРјСғ СҒами.
РҡлаСҒСҒРёСҮРөСҒРәРёР№ РІРҫРҝСҖРҫСҒ РҪа фРҫСҖСғРјРө РҪР°СҲРёС… РәСғСҖСҒРҫРІ: вҖңР§СӮРҫ РҪРөВ СӮР°Рә СҒВ РјРҫРөР№ РҝСҖРҫРіСҖаммРҫР№?вҖқ РһСӮРәСҖСӢРІР°СҺ РҝСҖРҫРұР»РөРјРҪСӢР№ РәРҫРҙ, Р·Р°РҝСғСҒРәР°СҺ РҝСҖРҫРіСҖаммСғ, СҒСҖазСғ РІСӢРҙР°РөСӮСҒСҸ РҫСҲРёРұРәР° СҒВ СҖР°СҒСҲРёС„СҖРҫРІРәРҫР№. РҳРҪСӮРөСҖРөСҒРҪРҫ, СҮРөР»РҫРІРөРә, РәРҫСӮРҫСҖСӢР№ Р·Р°Рҙал РІРҫРҝСҖРҫСҒ, РҝСӢСӮалСҒСҸ Р·Р°РҝСғСҒСӮРёСӮСҢ РЎР’РһР® РҝСҖРҫРіСҖаммСғ? РҜРІРҪРҫ РҪРөСӮ. РўР°РәРҫР№ РҝРҫРҙС…РҫРҙ РҪРөВ РҝРҫР·РІРҫлиСӮ СҒСӮР°СӮСҢ С…РҫСҖРҫСҲРёРј РҝСҖРҫРіСҖаммиСҒСӮРҫРј. Р—Р°РҙаваСҸ РІРҫРҝСҖРҫСҒ РҪа фРҫСҖСғРјРө или в РәРҫРјРјРөРҪСӮР°СҖРёСҸС…, РҪСғР¶РҪРҫ СғСӮРҫСҮРҪСҸСӮСҢ, СҮСӮРҫ РәРҫРҪРәСҖРөСӮРҪРҫ РІСӢ СғР¶Рө РҝСҖРөРҙРҝСҖРёРҪСҸли РҙР»СҸВ СҖРөСҲРөРҪРёСҸ, РәР°РәРёРө РІР°СҲРё СҲаги РҫРәазалиСҒСҢ РұРөР·СғСҒРҝРөСҲРҪСӢРјРё.
РңРҪРҫРіРёРө СӮРөРјСӢ РҪР°СҲРёС… РәСғСҖСҒРҫРІВ вҖ” РҪР°РҝСҖРёРјРөСҖ, СҚР»РөРјРөРҪСӮСӢ С„СғРҪРәСҶРёРҫРҪалСҢРҪРҫРіРҫ РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёСҸ, Р°РҪРҫРҪРёРјРҪСӢРө С„СғРҪРәСҶРёРё, С„СғРҪРәСҶРёРё РІСӢСҒСҲРөРіРҫ РҝРҫСҖСҸРҙРәР°, РёСӮРөСҖР°СӮРҫСҖСӢ, РіРөРҪРөСҖР°СӮРҫСҖСӢВ вҖ” РҪРөВ СҒамСӢРө РҝСҖРҫСҒСӮСӢРө РІРөСүРё. РўСҖРөРұСғРөСӮСҒСҸ РІСҖРөРјСҸ РёВ СӮСҖСғРҙ, СҮСӮРҫРұСӢ СҚСӮР° РёРҪС„РҫСҖРјР°СҶРёСҸ СғР»РҫжилаСҒСҢ РІВ РіРҫР»РҫРІРө.
Р•СҒли РәажРөСӮСҒСҸ, СҮСӮРҫ СғСҮРёСӮСҢСҒСҸ РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёСҺ Р»РөРіРәРҫ, Р·РҪР°СҮРёСӮ, РІСӢ РҪРөВ СғСҮРёСӮРөСҒСҢ.
РһВ СҒРөРұРө
Р•СҒли РҙСғРјР°РөСӮРө, СҮСӮРҫ РјРҪРө РұСӢР»Рҫ Р»РөРіРәРҫ РёР·СғСҮРёСӮСҢ РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёРө, СӮРҫ РіР»СғРұРҫРәРҫ Р·Р°РұР»СғР¶РҙР°РөСӮРөСҒСҢ. РҜ СҒСӮР°СҖСӮРҫвал РҙРҫСҒСӮР°СӮРҫСҮРҪРҫ РҝРҫР·РҙРҪРҫ РҝРҫВ РјРөСҖРәам РҝСҖРҫРіСҖаммиСҒСӮРҫРІ, аж РҪа РҝРөСҖРІРҫРј РәСғСҖСҒРө Р’РЈР—Р°. РЎВ РҝСҖРөРҝРҫРҙаваСӮРөР»РөРј РҝРҫРІРөР·Р»Рҫ (РңР°СҖРёСҸ РңР°РәР°СҖРөРҪРәРҫ, Р·РҙСҖР°СҒСӮРө). Р‘СӢР»Рҫ СӮСҸР¶РөР»Рҫ, РәР°Рә СҒРөР№СҮР°СҒ РҝРҫРјРҪСҺ, РҙажРө РІР»РҫР¶РөРҪРҪСӢРө СҶРёРәР»СӢ РҝРҫРҪСҸСӮСҢ, а РҝСҖРҫВ СҖРөРәСғСҖСҒРёСҺ РІРҫРҫРұСүРө РјРҫР»СҮСғ. РһРҙРҪажРҙСӢ РҝРҫймал СҒРөРұСҸ РҪа мСӢСҒли: вҖңРҗВ РјРҫР¶РөСӮ РұСӢСӮСҢ, РҪРөВ СӮРІРҫРө СҚСӮРҫВ вҖ” РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёРө? РқСғ РјР°СӮРөРјР°СӮРёРә РёВ РјР°СӮРөРјР°СӮРёРә, СҖаз СҖРөРәСғСҖСҒРёСҺ РҪРөВ РјРҫР¶РөСҲСҢ РҝРҫРҪСҸСӮСҢвҖқ. РқРҫВ СҸ РҪРөВ СҒРҙалСҒСҸ, РҫСӮР»Рҫжил РҪРөРҝРҫРҪСҸСӮРҪРҫРө РІВ РҙалСҢРҪРёР№ СҸСүРёРә, РёВ РҙалСҢСҲРө РёР·СғСҮал РҝСҖРҫРіСҖаммиСҖРҫРІР°РҪРёРө. РҡРҫРіРҙР° РІВ СҒР»РөРҙСғСҺСүРёР№ СҖаз РІРөСҖРҪСғР»СҒСҸ РәВ СҖРөРәСғСҖСҒРёРё, РұСӢР» РҝСҖРёСҸСӮРҪРҫ СғРҙРёРІР»РөРҪ: РҝРҫРҪСҸР» РәР°Рә РҫРҪР° СҖР°РұРҫСӮР°РөСӮ РёВ РјРҫРі СҖРөСҲРёСӮСҢ РҝСҖР°РәСӮРёСҮРөСҒРәРё Р»СҺРұСғСҺ Р·Р°РҙР°СҮСғ РҪа СҚСӮСғ СӮРөРјСғ. РҡР°РәРҫР№ РІСӢРІРҫРҙ? РқРөВ СҒРҙавайСӮРөСҒСҢ! Р•СҒли СҮСӮРҫ-СӮРҫ РҪРөРҝРҫРҪСҸСӮРҪРҫ, СҮРёСӮайСӮРө РәРҪРёРіРё, СҮРёСӮайСӮРө РёРҪСӮРөСҖРҪРөСӮ (РІВ РјРҫРө РІСҖРөРјСҸ РёРҪС„РҫСҖРјР°СҶРёРё РұСӢР»Рҫ РҪамРҪРҫРіРҫ РјРөРҪСҢСҲРө, СҮРөРј СҒРөР№СҮР°СҒ), РҝРёСҲРёСӮРө РәРҫРҙ, СҖРөализСғР№СӮРө РҝСҖРҫРөРәСӮСӢ. РһСӮР»РҫжиСӮРө СҒР»РҫР¶РҪРҫРө, СҮСӮРҫРұСӢ СҖР°СҒСҒРјРҫСӮСҖРөСӮСҢ РөСүРө СҖаз РҝРҫР·Р¶Рө, РҝСҖРёВ СҚСӮРҫРј СҖР°РұРҫСӮайСӮРө РҪР°РҙВ СҒРҫРұРҫР№, СҖазвивайСӮРөСҒСҢ. Р’СҒРөРіРҙР° РјРҫР¶РҪРҫ РІРөСҖРҪСғСӮСҢСҒСҸ СҒВ РҪРҫРІСӢРјРё Р·РҪР°РҪРёСҸРјРё, СҒилами, СғРјРөРҪРёСҸРјРё. Р’СӢ РұСғРҙРөСӮРө РҝСҖРёСҸСӮРҪРҫ СғРҙРёРІР»РөРҪСӢ. РҹРҫРІРөСҖСҢСӮРө РјРҪРө.
Р’СӢРІРҫРҙ
РқРёРәР°РәРҫР№ РәСғСҖСҒ (РҙажРө РҪР°СҲРё РәСғСҖСҒСӢ рҹҳў) РҪРөВ СҒРҙРөлаСҺСӮ РёР·В РІР°СҒ РҝСҖРҫРіСҖаммиСҒСӮР° РұРөР·В СҒамРҫРҫРұСҖазРҫРІР°РҪРёСҸ. РҡСғСҖСҒСӢВ вҖ” лиСҲСҢ СҒРҝРҫСҒРҫРұ РҙРҫСҒСӮРёР¶РөРҪРёСҸ СҚСӮРҫР№ СҶРөли. РһРҪРё РјРҫРіСғСӮ СҒРҙРөлаСӮСҢ РҝСғСӮСҢ РәВ СғСҒРҝРөС…Сғ СғРҙРҫРұРҪРөРө РёВ РұСӢСҒСӮСҖРөРө.
РҰРөР»СҢ РҫРұСҖазРҫРІР°СӮРөР»СҢРҪСӢС… РәСғСҖСҒРҫРІВ вҖ” СҒРҙРөлаСӮСҢ РҝСҖРҫСҶРөСҒСҒ РҫРұСғСҮРөРҪРёСҸ РҝСҖРҫСүРө РёВ СҚффРөРәСӮРёРІРҪРөРө. РқРҫВ РҪРёРәСӮРҫ РІВ РјРёСҖРө РҪРөВ СҒРјРҫР¶РөСӮ СғСҮРёСӮСҢСҒСҸ за ваСҒ.
РўРёРјСғСҖ Р“СғРөРІ, авСӮРҫСҖ РәСғСҖСҒРҫРІ вҖңРҹРҫРәРҫР»РөРҪРёРө PythonвҖқ